Plus la molécule de référence est complexe, plus le procédé de fabrication devient complexe.
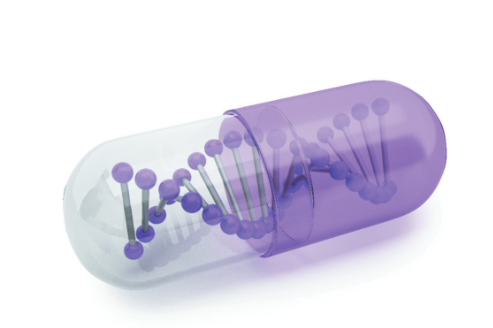
Les biomédicaments sont des médicaments produits à partir de cellules vivantes.1
Les biomédicaments existent depuis de nombreuses années, comme par exemple l’insuline qui traite le diabète. Des biomédicaments plus récents et plus innovants sont aujourd’hui utilisés pour traiter de multiples pathologies, dont les maladies inflammatoires et auto-immunes, les déficits en enzyme ou en hormone et certains cancers.
Les biomédicaments ont offert aux médecins de nouvelles options de traitement efficaces qui ont fortement amélioré le pronostic de maladies graves pour lesquelles il n’existait auparavant que peu ou pas de possibilités de traitement.
Les substances actives des biomédicaments sont de grosses molécules appelées « protéines » qui interagissent avec les cellules vivantes et ralentissent le processus de la maladie.2 Ces protéines sont beaucoup plus grandes et plus complexes que les substances actives chimiques telles que l’aspirine.1
La production d’un biomédicament est, elle aussi, un processus plus complexe que celui d’un médicament chimique. Des variations peuvent survenir au cours de ce processus parce que les biomédicaments sont fabriqués à partir d’organismes vivants et non par synthèse chimique.
En fait, il existe de légères variations entre lots d’un même biomédicament. C’est tout à fait normal et elles sont controlées.1
Médicament chimique
21 atomes
Biosimilaires de
1ère génération
3 000 atomes
(environ : insuline)
Biosimilaires
de médicaments
biologiques de pointe
20 000 atomes
Plus la molécule de référence est complexe, plus le procédé de fabrication devient complexe.

Comme c’est le cas pour tout nouveau médicament, un nouveau biomédicament est légalement protégé pendant une certaine période de temps par un brevet. Cela signifie que le laboratoire qui a développé le médicament bénéficie des droits exclusifs de production et de commercialisation de ce médicament.
Cette protection est accordée pour laisser au laboratoire le temps de récupérer le fort investissement consenti pour développer le médicament.
À l’expiration du brevet, d’autres laboratoires pharmaceutiques ont le droit de fabriquer ce médicament, que l’on désigne sous le terme de « biomédicament de référence ».
Dans le cas des médicaments chimiques, le développement par un autre laboratoire est relativement aisé : il faut reproduire la formule chimique du principe actif. On désigne ce médicament par le nom de « générique ».
Il n’est pas possible de produire une copie « générique » d’un biomédicament en raison de sa complexité et de son procédé de fabrication à partir de cellules vivantes.
Par contre, une molécule biologique peut être conçue de manière à être hautement similaire à la molécule biologique de référence, d’où le nom de biosimilaire.1
Aujourd’hui, plusieurs biomédicaments arrivent à la fin de leur brevet, et des sociétés de biotechnologie commencent à développer et à produire des biosimilaires. Les sociétés de biotechnologie qui développent des biosimilaires doivent se conformer à des critères extrêmement stricts pour démontrer leur équivalence avec le biomédicament de référence.
Le développement et la production d’un biomédicament sont des processus longs et complexes qui nécessitent, en moyenne, 13,5 ans de recherche et développement.
Temps de développement nécessaire
Téléphone cellulaire

2 ans
Automobile

3 ans
Médicament générique

3 à 5 ans
Médicament biosimilaire
7 à 8 ans
Biomédicament
13 ans
Le premier biomédicament à avoir été homologué a été l’insuline humaine en 1982.3
Depuis, plus de 185 biomédicaments ont été autorisés en Europe.3
En raison de la complexité des biosimilaires, la procédure imposée pour leur autorisation est extrêmement exigeante et strictement contrôlée.4
L’Agence Européenne des Médicaments (EMA), qui est responsable de l’Autorisation de Mise sur le Marché des médicaments au sein de l'Union Européenne, impose une procédure rigoureuse pour l’approbation des biosimilaires. Tout commence par une comparaison précise de toutes les caractéristiques essentielles à l’activité du biomédicament.
La procédure comprend aussi une évaluation du biosimilaire par le biais d’une étude clinique comparative directe avec le biomédicament de référence ; celle-ci doit démontrer l’absence de différences cliniquement significatives entre les profils de sécurité et d’efficacité des deux médicaments.4
Les médicaments biosimilaires sont produits en respectant les mêmes normes que celles des autres biomédicaments, et les autorités compétentes procèdent à des inspections périodiques de leurs sites de production.1
Les médicaments biosimilaires sont soumis aux mêmes procédures de surveillance strictes que tous les autres biomédicaments approuvés par l’EMA.
Il faut démontrer que les biosimilaires sont hautement similaires à leurs biomédicaments de référence en termes de :
Structure
Activité biologique
Qualité
Efficacité
Sécurité
![]()
Économies pour le système de soins de santé
Même si l‘investissement demeure important, leur moindre coût de développement fait que les biosimilaires peuvent être commercialisés à un prix inférieur à celui du biomédicament de référence.
Extension de l‘accessibilité aux traitements
En France, aujourd’hui, la prise en charge des traitements de maladies chroniques est assurée par notre système de santé. Cependant le nombre de malades et l’espérance de vie grandissant, les dépenses de santé risquent de mettre en échec l’accessibilité de tous les patients à ces traitements. Les biosimilaires représentent un moyen de contribuer à limiter ces dépenses et prolonger l’accessibilité aux traitements.
Financement des innovations futures
Les innovations futures, comme la mise à disposition d’un traitement curatif pour un grand nombre de maladies, risquent de se trouver compromises parce que la charge économique qu’elles représentent pour notre système de santé fait qu’il devient de plus en plus difficile de les financer. Les biosimilaires représentent un moyen de contribuer à limiter les coûts et à financer les innovations de demain.
Les biomédicaments sont des molécules de grandes tailles et complexes qui sont produites dans des organismes vivants.
Un biosimilaire est une version similaire à un biomédicament de référence. Cette similarité en termes de qualité, de sécurité et d’efficacité, a été démontrée par le biais d’une procédure d’autorisation rigoureuse.
Les biosimilaires sont développés afin de limiter les dépenses de santé pour étendre l’accessibilité aux traitements et permettre la prise en charge économique des innovations futures.